Il legame chimico è una forza di attrazione intramolecolare, ovvero “interna” alla molecola, che tiene uniti tra di loro i suoi atomi. Esistono anche forze di attrazione intermolecolari che consentono alle molecole di aggregarsi tra di loro per dar luogo agli stati condensati della materia: i solidi e i liquidi. Queste forze di attrazione sono chiamate legami intermolecolari, note anche come forze di Van der Waals, dal dello scienziato che le ha studiate. Tali forze sono molto più deboli rispetto a quelle di un legame covalente, tuttavia esse sono le responsabili delle principali proprietà delle sostanze. Ci sono tre tipi di forze che regolano i legami intermolecolari:
Le forze dipolo-dipolo
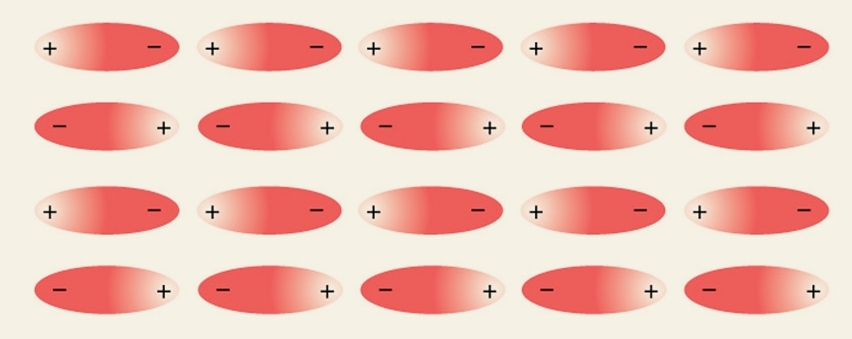
agiscono tra molecole polari. Una molecola è detta polare quando è presente un dipolo, ovvero quando una parte di essa e parzialmente negativa ed un’altra parzialmente positiva. Queste forze derivano dalla tendenza delle molecole polari di orientarsi rivolgendo l’estremità positiva verso l’estremità negativa della molecola successiva. Ciò provoca una reazione elettrostatica che tiene unite le molecole.Possiamo quindi affermare che:
“Le forze dipolo-dipolo sono forze di attrazione tra le cariche elettriche parziali positive e negative delle molecole polari.”
Ecco un’immagine che rappresenta come le molecole polari si dispongono durante la relazione.
Le forze di London
Anche tra le molecole non polari posso esistere delle forze simili a quelle dipolo-dipolo. A causa del moto caotico degli elettroni al loro interno, la carica elettrica attorno ad atomi o molecole può sbilanciarsi per brevi istanti creando dei dipoli temporanei ,meno forti dei dipoli permanenti, e responsabili delle forze di attrazione chiamate forze di London.
“Le forze di London derivano dall’attrazione dei dipoli istantanei tra molecole vicine“
La forza e l’efficacia delle forze di London aumenta con la massa molecolare; più le molecole sono grandi, maggiore sarà la possibilità di avere dipoli istantanei, in quanto il numero di elettroni sarà maggiore.
Il legame ad idrogeno.
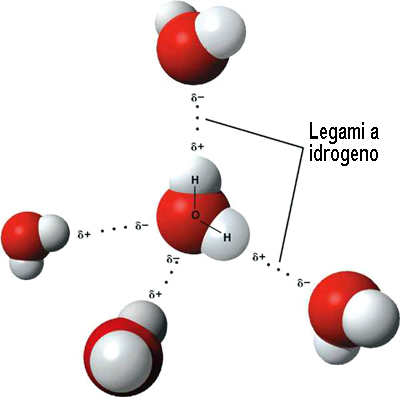
Il legame a idrogeno è un caso di legame dipolo-dipolo particolarmente forte il più forte tra i legami intermolecolari. Esso si instaura tra molecole che portano atomi di idrogeno legati ad atomi fortemente elettronegativi quali F (Fluoro) ,O (Ossigeno) e N (Azoto). In questo caso le attrazioni tra i dipoli sono particolarmente forti, tali da essere chiamate legami ad idrogeno. L’atomo di idrogeno, a causa della sua elevata carica positiva, provoca la formazione di veri e propri “ponti di collegamento” tra se stesso e l’atomo più elettronegativo di un’altra molecola
“.Il legame a idrogeno si instaura tra molecole polari contenenti un atomo di idrogeno e uno dei tre elementi F,O e N i cui atomi sono piccoli ed elettronegativi.”
Esso non ha effetto sulle proprietà chimiche, mentre influenza quelle fisiche. Ad esempio l’acqua, data dal legame H20, ha una temperatura di ebollizione pari a 100°. Un valore eccezionalmente alto dovuto proprio ai legami ad idrogeno instaurati tra le molecole.